Recent Posts
Get in touch!
Fusce varius, dolor tempor interdum tristiquei bibendum service life.
- +32 3 689 85 38
- Technology Lane 82, 9052 Ghent Belgium
- info@gulliverbiomed.com
Fusce varius, dolor tempor interdum tristiquei bibendum service life.
当社では、高品質のラクダ科動物由来のカスタム単一ドメイン抗体(sdAb、別名VHH、ナノボディ)を提供しています。ナノボディの発見と、多様な生物学的および臨床的背景での適用における25年以上のノウハウをご活用ください。また、自社開発のナノボディも提供しています。

これらの問題は、ナノボディでは発生しません。
ラクダ科動物由来の重鎖抗体(HcAb)は、ベルギーのブリュッセルで発見されました(下図参照)。このようなHcAbの抗原結合断片は、ナノボディ、VHH、または単一ドメイン抗体と呼ばれています。ベルギーは、学界や民間企業の両方でナノボディ研究の中心地となっています。
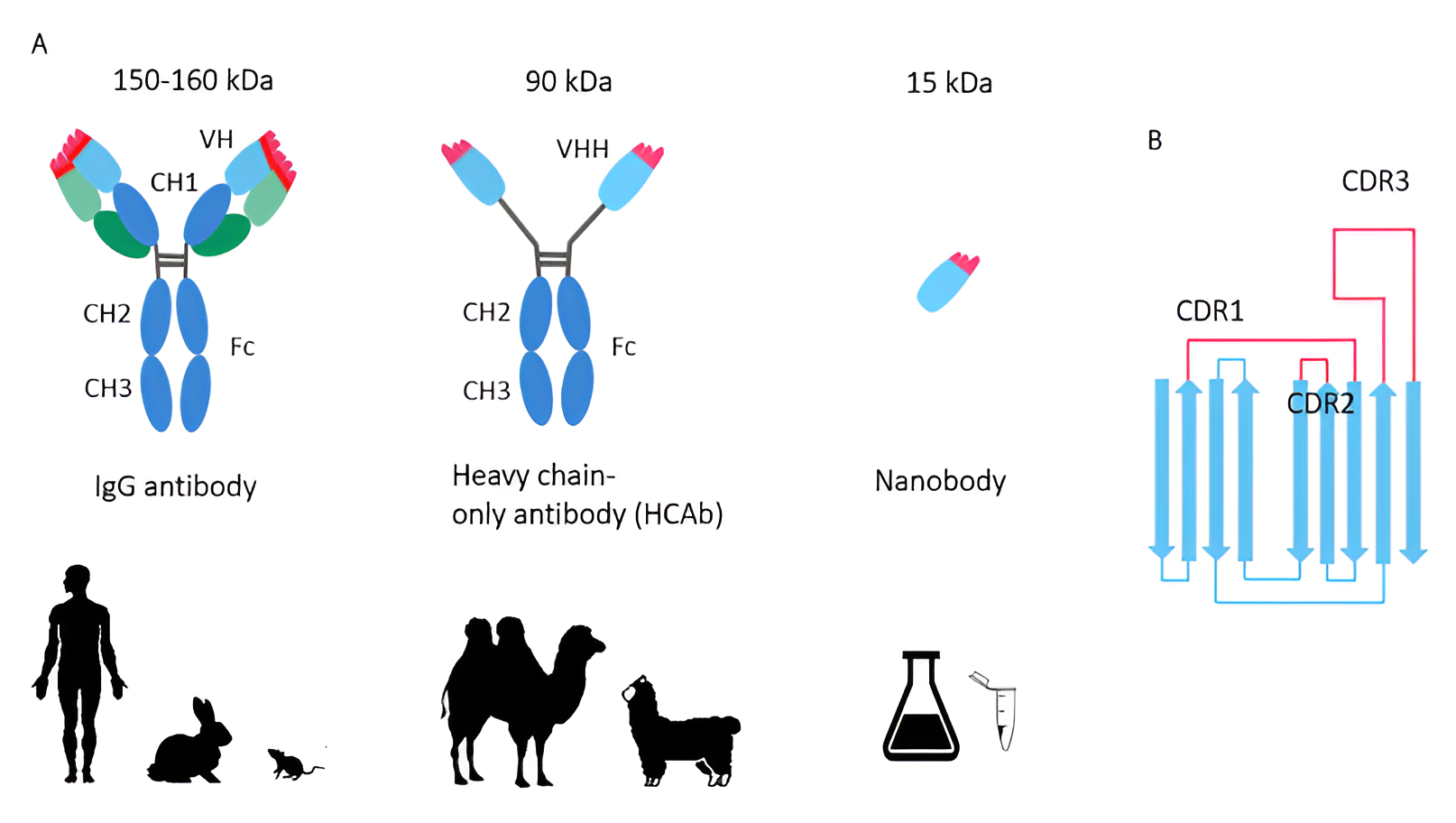
従来の抗体、重鎖抗体(HCAb)およびナノボディ(Nbs)(A)HCAb(中央)は、2つの重鎖のみから構成されています。その抗原結合部分はVHHであり、約120 aa(15 kDa)の単一アミノ酸鎖です。(B)ナノボディのCDR(相補性決定領域、赤)とFR(フレームワーク領域、青)。CDRは抗原結合に重要であり、通常はIgGのCDRよりも長く、酵素触媒部位などの到達が困難なエピトープにナノボディがアクセスできるようにします。
今後の助成金申請にこの技術を盛り込むことをご検討ください。今すぐのお問い合わせもお待ちしております。。当社がプロセスをご案内し、最新情報をお届けします。また、ご希望のVHHを入手された後も、引き続きサポートいたします。当社の学術部門の研究者は、20年以上にわたり研究現場でこの技術を活用しています。
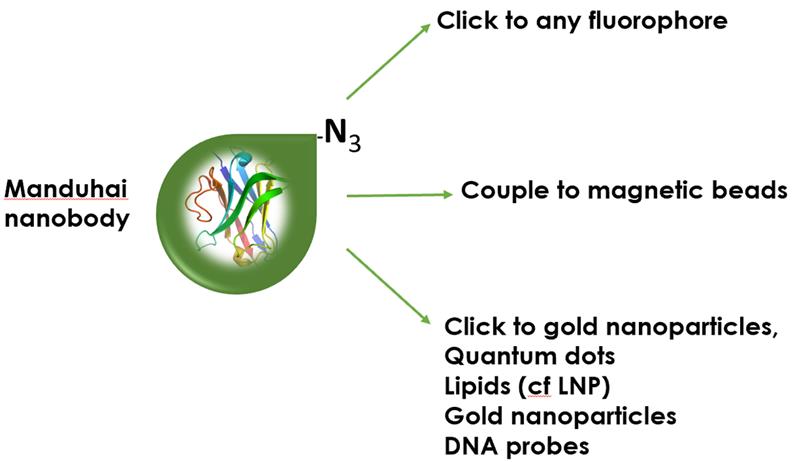
基礎医学や応用医学(バイオ医学)、動物科学、植物科学、薬理学、ウイルス学、微生物学、(超解像)顕微鏡検査、ワクチン、漁業など、研究分野を問わず、VHHは従来の遺伝子アプローチや従来の抗体では得られない生物学的/臨床的情報を解明する多くの機会をもたらします。その理由は、タンパク質があらゆる生物にとって必須の構成要素であり、最も基本的な形で健康と病気に寄与しているからです。
遺伝子アプローチは、必然的に標的タンパク質の全機能を失わせるだけでなく、その相互作用ネットワーク全体を消滅させてしまいます。タンパク質は多くの関連物質を持ち、細胞機能を支える相互作用ネットワークを構築しています。研究にVHH/ナノボディを導入することで、プロジェクトに新たなレベルが加わり、これまで答えることができなかった新しい疑問を提起し、実験的に解決することが可能になります。
VHHがIgGよりも優れる主な例